La enteritis necrótica (EN) aguda a menudo parece surgir como un aumento abrupto en la mortalidad entre aves que aparentemente estaban sanas hasta poco antes de morir. La mortalidad puede sobrepasar el 20% de las aves de la parvada, en la que suceden muertes entre los pollos de engorda de más rápido crecimiento. Las aves afectadas aparecen repentinamente enfermas y se pueden morir en pocas horas. El agente causante, identificado en 1961 (Parish, 1961) es el Clostridium perfringens (CP) una bacteria formadora de esporas que se puede encontrar en el suelo, cama avícola, incubadoras y como miembro normal de la microbiota de aves y otros animales sanos (Wilson et al., 2005). La enfermedad se observa más comúnmente de forma clínica en pollos de engorda de 18-28 días de edad, aunque puede darse en forma subclínica y a otras edades (Wages et al., 2003). La restricción del uso de antibióticos terapéuticos y antibióticos en alimentos balanceados en todo el mundo ha resultado en mayores niveles de EN (Dahiya et al., 2006).
En todas partes del mundo donde hay avicultura se ha informado de la existencia de la EN (Wilson et al., 2005), la cual se considera como una de las enfermedades intestinales de pollo de engorda más económicamente importantes. El objetivo de esta revisión es el de colocar a la enteritis necrótica dentro del contexto de la salud digestiva y de la ecología microbiana, con el objetivo de mostrar que esta enfermedad es el resultado de un proceso multifactorial que a menudo se desarrolla en un período de varias semanas.
La identificación de la EN por lo general sucede en la necropsia y se hace con base en la combinación de patología y cultivo bacteriano. Las aves afectadas con frecuencia muestran lesiones intestinales como el único cambio patológico, aunque se ha informado de congestión e hipertrofia hepática y renal. La identificación definitiva de la EN depende del aislamiento del C. perfringens del intestino de las aves afectadas. Es muy importante el uso de la bacteriología para diferenciar a la EN de la coccidiosis relacionada con Eimeria maxima (Williams, 2005), además de que no debe considerarse definitivo el diagnóstico sin los resultados del cultivo anaeróbico. Las lesiones intestinales pueden estar confinadas al yeyuno e íleon, pero también se pueden encontrar en el duodeno o en el intestino posterior. La mucosa intestinal se presenta necrótica y puede estar completamente ausente, reemplazada por fibrina y desechos celulares (Wages y Opengart, 2003).
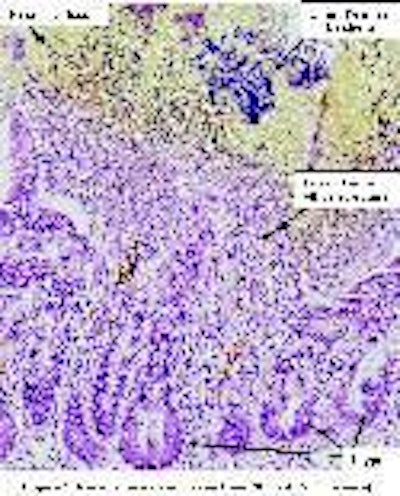
La figura 1 presenta lesiones de un ave con EN bacteriológicamente confirmada. El límite entre el tejido necrótico (amarillo) y el vivo (rosado) muestra la extensión de la difusión de la toxina alfa. Las puntas de las vellosidades han desaparecido por completo, sustituidas por una masa amorfa de material necrótico. Dentro del tejido necrótico se pueden observar bacterias gram positivas. El resto de la mucosa está limitada a tejido conectivo que rodea las criptas dañadas y degeneradas. Se destruye por completo la función de barrera debido a la pérdida de enterocitos con sus consiguientes uniones ajustadas y su membrana basal.
Aunque la mortalidad relacionada con la EN aparece repentinamente, el proceso de la enfermedad puede ser de una duración mucho más larga. Ha habido cada vez más reportes de enteritis subclínica por CP y colangiohepatitis que persiste en granjas en particular a lo largo de muchas generaciones de aves que resulta en un bajo desempeño crónico (Lovland y Kaldhusdal, 2001; Wilson et al., 2005). Típicamente, el ave sobrevive, pero puede ser decomisada en la planta de procesamiento debido a colangiohepatitis. El hígado puede estar pálido y firme con evidencias histológicas de infección e hiperplasia de los conductos biliares (Onderka, 1990).
Estas observaciones conducen a preguntas centrales con respecto a cómo un habitante normal del sistema gastrointestinal puede convertirse en un patógeno oculto o manifiesto y a qué se puede hacer para minimizar este suceso. Para encarar esto, vamos a considerar al CP en el contexto de la ecología microbiana intestinal y los sucesos que pueden causar un crecimiento microbiano anormalmente alto en nichos donde normalmente no predominan. Esta condición, en la que las bacterias que normalmente se encuentran en el intestino posterior crecen en exceso y se hacen numerosas en el intestino delgado, ha sido llamada disbacteriosis (Wilson, 2005). Se ha descrito en varias especies, mientras que en humanos ha sido llamada proliferación o crecimiento excesivo bacteriano del intestino delgado (Johnston 1999).
Condiciones que favorecen C. perfringens
Se ha demostrado que el intestino de las aves padece un movimiento antiperistáltico (Duke, 1982) que resulta en la transferencia del contenido del intestino posterior al yeyuno e íleon (Sacranie et al., 2006). No obstante, las condiciones del íleon no favorecen el crecimiento de bacterias anaeróbicas intolerantes al ácido, como el CP. Además, el íleon tiene una disponibilidad relativamente baja de los aminoácidos que se requieren para el crecimiento del CP. Estas condiciones normalmente limitan la reproducción del CP que se transfiere del ciego al íleon.
Se han hecho muchos experimentos para dilucidar los factores que favorecen el crecimiento excesivo del CP en el intestino delgado. Tanto las dietas como las prácticas zootécnicas tienen un papel importante en el control de la cantidad de CP. Recientemente se hizo una revisión de las estrategias para controlar la EN (Dahiya et al., 2006), las cuales incluyen el control de la carga de CP y el mejoramiento de las respuesta inmunológica al CP (y a la toxina alfa responsable de gran parte de su patogenicidad) (Titball et al., 2000). El aseguramiento del uso de fuentes altamente digestibles de proteína va a minimizar las concentraciones de aminoácidos en el intestino grueso. De entre las recomendaciones de ingredientes específicos se encuentra la minimización del uso de granos tales como el trigo, centeno y cebada, que tienden a relacionarse con frecuencias mayores de EN subclínica que las dietas a base de maíz (Kaldhusdal y Hofshagen, 1992).
Además, si se deja a las parvadas sin alimento por períodos cortos seguidos de alimentación puede aumentar la oportunidad de transferencia bacteriana del intestino posterior al intestino delgado y el potencial de crecimiento excesivo. Por otra parte, el CP es un organismo mucolítico (Deplancke, 2002) y se ha documentado que la falta de nutrición intestinal aumenta la síntesis de ARNm de mucina y el tamaño de las células caliciformes dentro de todos los segmentos del intestino delgado (Smirnov et al., 2004). Se ha informado que el tamaño de partícula más grande es benéfico y se ha demostrado que el uso de trigo integral reduce la cuenta de CP intestinal (Engberg et al, 2004 y Bjerrum et al., 2005 in Dah).
Se ha demostrado que la proteína animal alta de la dieta aumenta la carga de CP, tanto en términos de contaminar el alimento con el mismo CP como de favorecer el consiguiente crecimiento mediante un aumento en la disponibilidad de aminoácidos (Titball et al., 1999). Otro factor de la dieta que puede afectar la ecología microbiana intestinal es la grasa. El uso de grasa oxidada no estabilizada puede llevar a cambios en la población bacteriana (Dibner et al., 1996; Hoerr, 1998). Ferket et al., (1996) mostraron que las micotoxinas de la dieta y la grasa oxidada están relacionadas con la incidencia de EN. Otro nutriente importante es el zinc, que es un componente de una de las toxinas enzimáticas en sí, y que también es necesario para la resistencia de la toxina a la digestión proteolítica (Baba et al., 1992). Ya que estos efectos requieren de zinc libre, el uso de la forma quelatada del zinc podría mejorar la capacidad del ave para digerir la toxina alfa del CP una vez secretada en el lumen intestinal. Así, tanto el tipo de ingrediente como su calidad pueden afectar la cantidad de CP intestinal.
Estrategias de manejo
Las estrategias de manejo para el control de la EN están bien establecidas, de las cuales la calidad de la cama tal vez sea la más importante (Craven et al., 2001). Específicamente, debe mantenerse seca la cama. Esto se logra a través de la selección de material de cama, manejo de los bebederos y suministro de ventilación adecuada (van der Sluis, 1996). Los muchos factores que contribuyen a la cama húmeda, recientemente revisados por Williams (2005), hacen que su manejo sea difícil y esencial para controlar la EN.
La relación entre la coccidiosis y la enteritis necrótica ha sido estudiada durante muchos años (Williams, 2005). La creencia de que están relacionadas, es decir, que no solamente son dos infecciones que colonizan a un solo huésped al mismo tiempo, se ve reflejada en el uso frecuente de desafíos coccidianos iniciales en sistemas de modelos con los que se busca representar la EN clínica y subclínica (Al-Sheikhly y Al-Saieg, 1980; Shane et al., 1985 Williams et al., 2003; Jansman et al., 2003a; Hofacre et al., 1998; Collier et al., 2003). La Eimeria acervulina y la E. maxima son las especies usuales y las dosis de oocistos son muchas veces mayores que una dosis de vacunación (Williams, 2005). De esta forma, aún se cuestiona el papel de la vacunación coccidiana con vacuna viva en los brotes de EN. Debe también hacerse notar que los modelos de EN han sido y continuarán desarrollándose basándose solamente en el desafío de CP (Dahiya et al., 2005, 2006).
Así, la infección coccidiana puede tener un papel permisivo, al mejorar las condiciones que favorecen el crecimiento del CP simplemente debido al daño de la mucosa que causan como parásitos intracelulares (Williams, 2005). La fuga resultante de proteína de plasma puede provocar la proliferación del CP al suministrar algunos de los aminoácidos esenciales y otros nutrientes que se requieren pare el crecimiento y la producción de toxinas (Fuchs y Bonde, 1957; Muhammed et al., 1975; Petit et al., 1999). Otra posibilidad es que el epitelio intestinal dañado es más accesible para la fijación del CP, lo que puede facilitar su crecimiento y ciertamente va a reducir el transporte de éste hacia fuera del cuerpo con las excretas. Así, el papel de la coccidiosis en los brotes de EN es que es uno de los muchos organismos infecciosos que contribuyen a la enteritis subclínica en pollo de engorda (Hoerr, 1998); sin embargo, la enteritis en sí misma no es suficiente para causar EN, debe venir precedida de condiciones que favorezcan la proliferación del CP en el intestino delgado.
Hoerr (1998) ha estudiado la patogénesis de la enfermedad intestinal y la frecuencia de la enteritis subclínica en parvadas de pollos de engorda. De entre los componentes de la enteritis catarral (Jones et al., 1997) que comúnmente se observan en pollos de engorda de 4-6 semanas de edad, se incluye una mayor producción de mucina, necrosis de enterocitos, atrofia de las vellosidades, hiperplasia del epitelio de las criptas e infiltración de linfocitos, entre otros (Hoerr, 1998). El aumento en la secreción de fluidos intestinales a menudo resulta en diarrea y cama húmeda. Se ha informado que la mayoría de estas cosas aumenta la cantidad de CP en el intestino (Williams, 2005). Esta enteritis generalmente subclínica está causada por cualquiera de una gran variedad de infecciones bacterianas y virales parasitarias leves, así como por desafíos tóxicos transitorios.
La frecuencia de este problema y los múltiples factores causantes concuerdan muy bien con la observación común de que la proliferación de CP y la EN aguda son procesos multifactoriales (Williams, 2005) sin remedios consistentes sencillos. Indica que están involucrados una combinación de prácticas de la dieta y de zootecnia, y procesos infecciosos, además de que el control tanto del crecimiento en exceso de CP en el intestino delgado como de la enteritis subclínica son la clave para reducir los brotes de EN.



.png?auto=format%2Ccompress&fit=crop&h=167&q=70&w=250)